过关科创,百济神州“三地上市”的玄机
百济神州的全球化布局成效已显,未来,海外产品收益将大幅提高

11月24日,百济神州宣布其BTK抑制剂百悦泽获得欧盟的批准,由此实现了全球40个国家的获批,海外商业化版图大幅扩展。PD-1也已经递交了“出海”的首个上市申请。
而就在11月16日,百济神州获中国证监会同意,在科创板首次公开发行股票注册,即将成为第一家在美股、港股和A股“三地上市”的生物科技企业。
广州生物药生产基地的生物制剂最高产能可能达到20万升,这是百济神州在招股说明书里披露的惊人数据。
放眼全球主流的CDMO公司,按规划到2022年底,百济神州的最大释放产能可以排入全球前五,仅次于瑞士龙沙、德国勃林格殷格翰,接近韩国三星生物,超过韩国Celltrion。
要知道,百济神州不是一家CDMO公司,只是一家生物医药公司。
为什么需要这样惊人的产能?
今年8月,在百济神州2021年全球研发日投资者电话会上,公司公布了最新的产品管线:临床前项目超50项,其中约有一半具备Fist in class潜力;内部建立了大量新技术和新药物模式,包括当前火热的双抗/多抗、PROTAC、ADC等;包括TIGIT,Bcl-2,HPK1等在内的多款具备差异化的在研管线已陆续进入关键临床阶段。
显然,不论研发、商业化还是生产,百济神州正全面进入新的关键发展期:全球化逐渐成型,研发体系走向纵深,创新成果渐近集中收获期。
在中国的土地上,时间能给创新药企带来什么?百济神州用11年给出了一份答案。
研发投入高,但回报意在长远
成立的第一个十年,百济神州内部推动了11款候选药物进入临床,其中三款产品已经其中上市,包括BTK抑制剂泽布替尼、PD-1抗体药物替雷利珠单抗,以及PARP抑制剂帕米帕利。
截至去年9月,百济神州在这三款产品上的研发投入了85亿元,主要用于推进大量、大规模的全球临床试验。其中,泽布替尼的35项临床试验中,开展了两项大型3期头对头临床试验,直接“叫板”伊布替尼;替雷利珠单抗的35项临床试验,有一半左右在海外;帕米帕利的海外临床数量多达9项。
众所周知,国外不仅蔬果贵,临床试验更贵。百济神州高级副总裁、全球研发负责人汪来曾表示:国外单个3期临床试验的开销动辄十几亿人民币。
投入换来的是国际上对药物品质的认可。
2019年,FDA授予泽布替尼突破性疗法认定,这是FDA首次为中国研发的抗癌新药颁布突破性疗法认定。同年年底,泽布替尼正式在美国获批,成为中国第一个在美上市的创新药物,一度刷爆朋友圈。
在日趋拥挤的国内创新药市场上,商业化已经逐步替代研发成果,成为考核药企的指标之一。财报显示,百济今年第三季度的营收为2.06亿美元,同比增长126.66%。净亏损4.14亿美元,与去年同期基本持平。从数字上来看,百济确实在逐步向好。
具体到产品上,替雷利珠单抗上市以来,除今年一季度因给经销商补差价有所下降,其他时间均持续增长。二季度医保放量后,销售额总计达到1.52亿美元,达到上市以来的巅峰;泽布替尼的增势则更加强劲,二、三季度分别实现营收4240万美元和6580万美元,同比增长均超过300%,全球销售额放量正在加速。
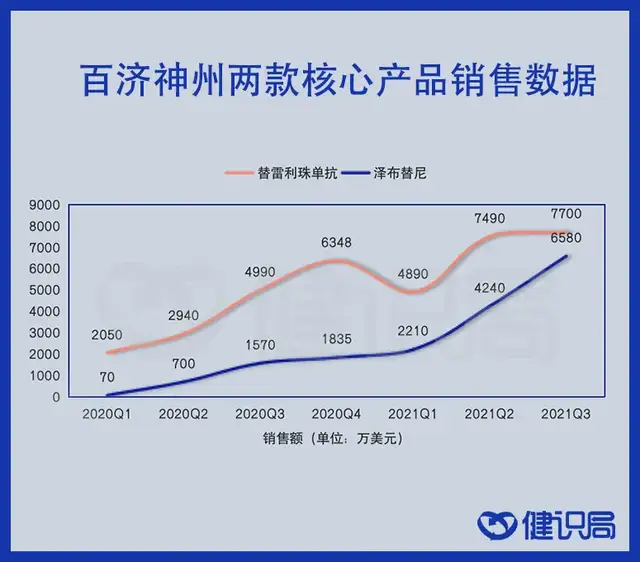
数据来源:百济神州财报
上市一年多来,这两款药品的总收入达到5.36亿美元左右,折合人民币34亿元以上,产品的转化效率相当可观。
健识局获悉,在百济目前近50项临床阶段候选物与商业化产品梯队中,包括TIGIT、Bcl-2、PI3Kδ、OX40等在内的多款在研管线基本都进入了关键性临床阶段。
在百济成立的前几年,公司未有产品上市,只能闷声做研发。如今,随着研发体系基本成型,创新成果也正在先后进入收获期。
第二道考验
创新药企常会面对的问题是:一群“搞科研”的人,会卖货吗?
找来专业的人、提早布局,是百济神州的办法。
2019年,百济神州总裁吴晓滨曾向健识局透露:为了泽布替尼在美上市,公司已经准备了超过一年的时间。那年11月,FDA正式批准时,当地销售团队已完成搭建,且全部培训完毕。
前瞻性的战略,是产品商业化的另一重关键。一名曾在百济工作过的员工对媒体透露,吴晓滨团队在百济“还没有很多药可以卖”时,就已经做出规划:必须大力推动创新药进医保。
2020年年底,踩着政策的东风,百济自研的两款核心药品和一款引进药物、共5项适应症全部进入医保,降价带来的是业绩的大幅增长。财报显示,百济神州第三季度产品收入1.925亿美元,来自这三款药的收入就达1.89亿美元,占比超过98%。
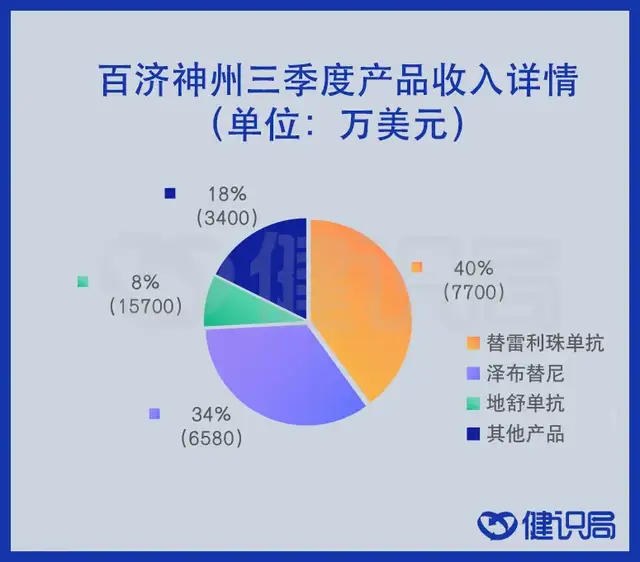
数据来源:百济神州2021年三季报
根据招股书,百济目前“已在中国及美国建立了实质性商业能力”。资料显示,百济在中国的商业化团队规模超过3100人,覆盖医院达到1000 家以上,在美国、欧洲等地的商业化团队规模也已超过190人。
授权,是加快药品出海的另一大策略。今年1月,百济与诺华达成合作,授权对方在美国、加拿大等十余个国家和地区开发、生产和商业化替雷利珠单抗。作为回报,百济获得了高达6.5亿美元的首付款,总交易金额将超22亿美元。刷新了中国本土创新药单品授权合作最高首付和总交易金额的记录。
今年9月,吴晓滨对外界透露,百济的海外收入正在不断增加。今年三季度,泽布替尼在海外卖出了3370万美元,同比增长超过490%,占全球总销售额的一半左右。
在创新药企的全球化布局上,这样的成绩只是一个开始。
执着的“国际化之路”
国际化,是许多本土创新药企的星辰大海。
此前,谈及百济神州为什么要出海时,汪来曾对健识局表示,受国内医保政策的影响,出海是一个必要的商业拓展办法。但更重要的是,“好的产品,就应该走向全球”。
然而,作为首批尝试出海的药企之一,百济神州最初经历了许多困难。汪来坦言,前期也曾面临过人员变动、团队重建等诸多问题,“这是必须经历的成长的阵痛。”
是否要选择出海这条路,首要问题在于品种。汪来认为,不是所有品种都具备出海的潜力。受制于行业发展水平影响,许多产品在海外已经有了同类药上市,作为后来者,想要抢占市场,除非证明自己是best in class。
其次则在于临床开发的能力。想要出海,开展全球大型3期试验是避不开的门槛。1期临床相对简单,可能只要找到一个靠谱的CRO就能完成;到3期时,企业往往需要开100到200个临床中心,而且还要同时和多个国家的药监部门进行沟通。
这意味着,一份文件要翻译成很多种语言,哪怕是发药和送药,都有完全不同的操作方式。百济神州的全球药政事务负责人闫小军也曾在采访中介绍,比如在泽布替尼的出海历程中,就曾在伊斯兰国家由于文化和宗教原因,不能够使用猪源性的明胶,而注册团队必须提前考虑替代方案。
对于创新药企业来说,临床试验过度依靠CRO,很可能产生问题。2020年新冠疫情期间,就曾闹出“一猴多用”的闹剧。
正因如此,百济神州从2018年开始建设自己的“全流程体系”。招股书显示,公司目前已经建立抗肿瘤靶点和药物技术平台,能够全方面覆盖分子靶向药物、免疫肿瘤学疗法、联合疗法等,实现了生产和临床开发之间的无缝衔接。

截至今年11月,百济神州已经在超过40个国家和地区执行了近100项临床试验,其中包括38项3期或潜在注册可用的临床试验,全球入组的14000患者中,海外患者过半。
据健识局了解,目前,无论是在海外已上市新药数量、覆盖市场数量,还是海外临床试验开展数量等方面,百济在国内均处于明显领先地位。
以泽布替尼为例,截至最新招股书披露,公司在全球范围内已开展了35项泽布替尼单药治疗或联合用药的临床试验,入组患者超过3900名,其中海外入组患者接近3000名。
如今,经过上交所的层层审核后,百济即将登录科创板,这既是对企业过去成绩的褒奖,也体现了市场对创新本质的认可。科创板对真正创新的肯定,也将吸引更多创新药企的回归。
文 | 古月
运营 | 廿十三
每天两篇深度稿件,解码医药健康
#百济神州##百济即将登录科创板##百济神州递交PD-1出海上市首个申请#
TOP STORIES
相 关 推 荐




 京公网安备11010502039624号
京公网安备11010502039624号